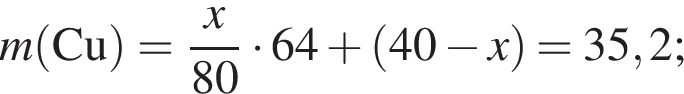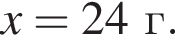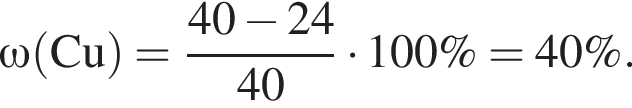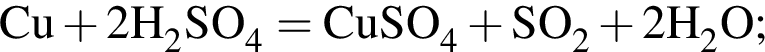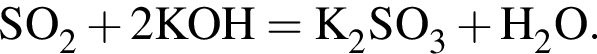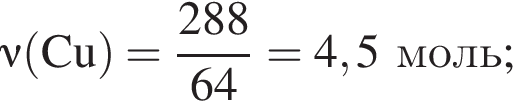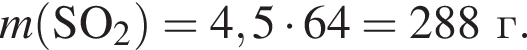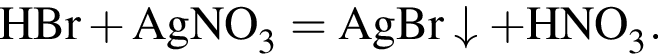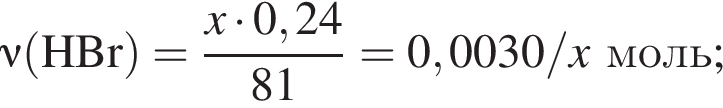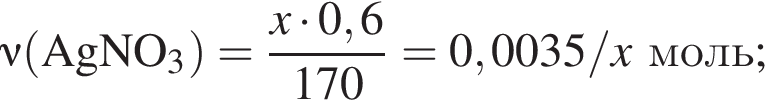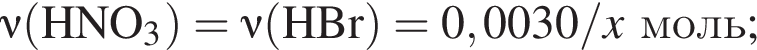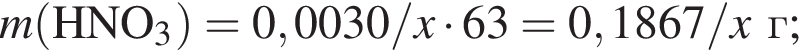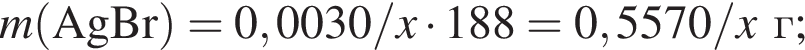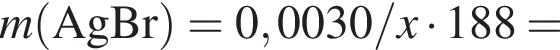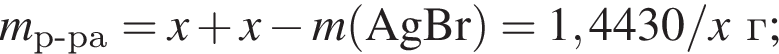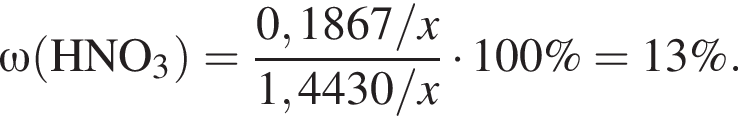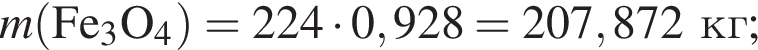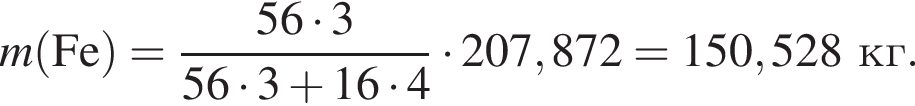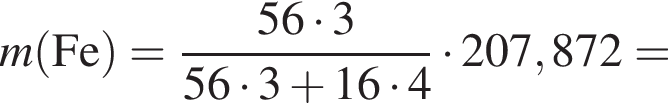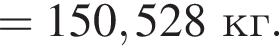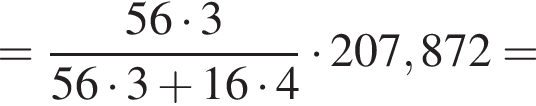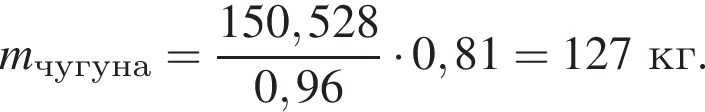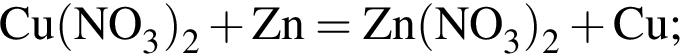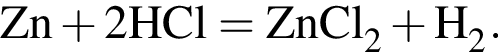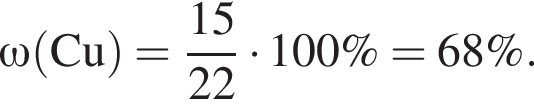Укажите символ химического элемента:
В атоме химического элемента 24 электрона. Его относительная атомная масса равна:
Трёхзарядный катион (Э3+) имеет конфигурацию 1s22s22р5. Укажите число неспаренных электронов в атоме элемента Э в основном состоянии:
Электронная конфигурация  соответствует основному состоянию атома элемента:
соответствует основному состоянию атома элемента:
Ионная связь имеется во всех веществах ряда:
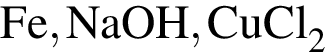
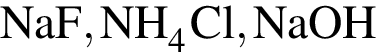
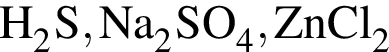
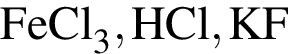
Для осуществления превращения 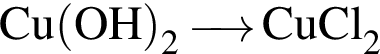 можно использовать раствор вещества, формула которого:
можно использовать раствор вещества, формула которого:
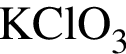
Установите соответствие между формулой вещества и степенью окисления атома химического элемента, указанного в скобках.
1 — 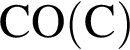
2 — 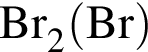
3 — 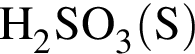
ХИМИЧЕСКОГО ЭЛЕМЕНТА
а — +2
б — +4
в — +6
г — 0
д — −1
С помощью прибора, указанного на рисунке, способом вытеснения воды можно с минимальными потерями собрать газ:
Как кислотными, так и основными свойствами обладает каждый из оксидов ряда:
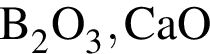
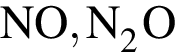
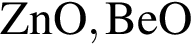
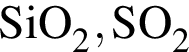
Природный минерал корунд, использующийся как абразивный материал, является:
Согласно положению в периодической системе наиболее выраженные металлические свойства проявляет элемент, электронная конфигурация внешнего энергетического уровня которого в основном состоянии:
Бескислородная одноосновная кислота образуется в результате превращения (электролиты взяты в виде водных растворов):
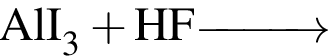
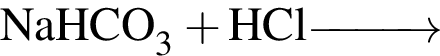
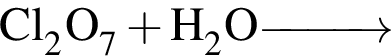
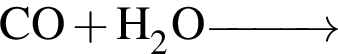
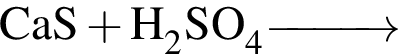
Укажите НЕПРАВИЛЬНОЕ утверждение относительно водорода:
Укажите правильные утверждения относительно вещества, химическая формула которого 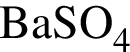 :
:
а — является средней солью
б — хорошо растворимо в воде
в — имеет название сульфат бария
г — мольное отношение катионов и анионов в формульной единице 1 : 4
Число веществ из предложенных — 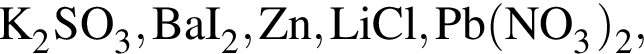 которые реагируют (20 °C) с раствором сульфата натрия, равно:
которые реагируют (20 °C) с раствором сульфата натрия, равно:
Исходные концентрации веществ А и В, участвующих в одностадийной реакции А + В = С, равны соответственно 2,45 моль/дм3 и 1,94 моль/дм3. Через 48 с после начала реакции концентрация вещества А снизилась до 1,37 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества В (моль/дм3) через 48 с после начала реакции равны соответственно:
Дан перечень органических соединений: октан; метилэтиламин; пропантриол-1,2,3; изобутан; метан; анилин; фенол. Установите соответствие между названием класса и числом принадлежащих к этому классу соединений.
A) алканы
Б) многоатомные спирты
B) амины
Г) фенолы
1) 1
2) 2
3) 3
4) 4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4В3Г1. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
Установите соответствие между формулой полимерного материала и его названием.
А — 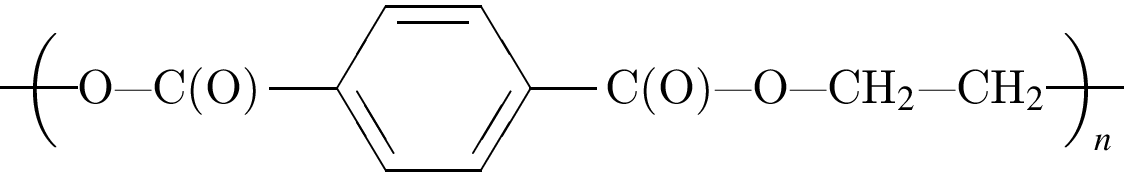
Б — 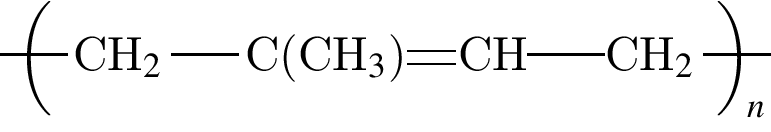
В — 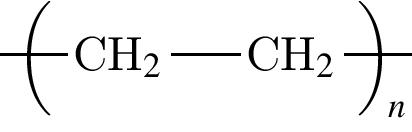
1) лавсан
2) полибутадиен
3) капрон
4) полиэтилен
5) полиизопрен
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: АЗБ1В4.
Для получения веществ по указанной схеме превращений
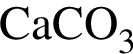 →
→ ![]() →
→ ![]() →
→ ![]() →
→ 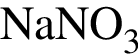
выберите реагенты из предложенных:
1 — ![]()
2 — 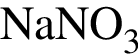
3 — 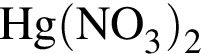
4 — ![]()
5 — ![]()
Ответ запишите цифрами в порядке следования превращений, например: 1224. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
Определите сумму коэффициентов перед формулами продукта окисления и продукта восстановления в уравнении химической реакции, схема которой
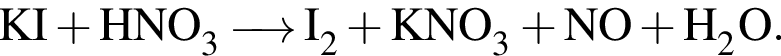
Установите соответствие между структурной формулой органического вещества и общей формулой гомологического ряда, к которому относится это вещество.
А)
Б)
В)
Г)
гомологического ряда
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б3В5Г1.
Для обратимой реакции 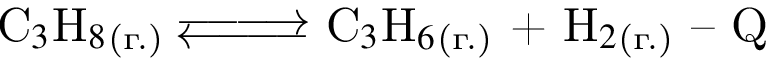 установите соответствие между воздействием на равновесную систему и направлением смещения равновесия.
установите соответствие между воздействием на равновесную систему и направлением смещения равновесия.
А) использование катализатора
Б) понижение температуры
В) повышение давления
Г) уменьшение концентрации продуктов
1 — вправо (в сторону продуктов)
2 — влево (в сторону исходного вещества)
3 — не смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2ВЗГ1
При упаривании раствора исходной массой 250 г массовая доля соли в нем увеличилась в 1,25 раза. К полученному раствору добавили эту же соль массой 40 г, которая полностью растворилась, а массовая доля соли в растворе стала равной 30%. Вычислите массовую долю (%) соли в исходном растворе.
При неполном окислении насыщенного ациклического одноатомного спирта образовался альдегид, объем паров которого в 6 раз меньше объема кислорода, необходимого для полного сгорания такой же порции спирта. Рассчитайте молярную массу (г/моль) спирта (объемы веществ измерены при одинаковых условиях).
Для анализа смеси, состоящей из ![]() и
и ![]() провели следующие операции. Навеску смеси массой 2,23 г растворили в воде. К полученному раствору прибавили 34,0 г раствора нитрата серебра(I) с массовой долей
провели следующие операции. Навеску смеси массой 2,23 г растворили в воде. К полученному раствору прибавили 34,0 г раствора нитрата серебра(I) с массовой долей 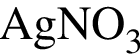 20%. Выпавший осадок отфильтровали, промыли, высушили и взвесили. Его масса оказалась равной 3,80 г. Вычислите массовую долю (%) ионов натрия в исходной смеси.
20%. Выпавший осадок отфильтровали, промыли, высушили и взвесили. Его масса оказалась равной 3,80 г. Вычислите массовую долю (%) ионов натрия в исходной смеси.
В шесть стаканов с разбавленными водными растворами поместили по одному железному гвоздю:
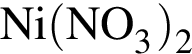
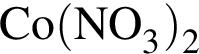
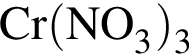
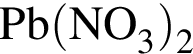
![]()
![]()
Определите число растворов, в которых масса гвоздя увеличилась. (Гидролиз не учитывать.)
При полном сгорании метана химическим количеством 1 моль в кислороде выделяется 890 кДж теплоты, а в озоне — 1032 кДж. В результате сгорания смеси объемом (н. у.) 34,608 дм3, состоящей из метана и озонированного кислорода (смесь озона с кислородом), газы прореагировали полностью с образованием углекислого газа и воды. Определите количество теплоты (кДж), выделившейся при этом, если доля озона в озонированном кислороде составляет 18% по объему.
Смесь азота с водородом при нагревании пропустили над катализатором. В результате реакции с выходом 70% был получен аммиак, а содержание водорода в полученной газовой смеси составило 68% по объему. Рассчитайте массовую долю (%) водорода в исходной газовой смеси.
Дана обратимая реакция

Установите соответствие между между воздействием на равновесную систему и смещением равновесия в результате этого воздействия.
А) увеличение концентрации хлора
Б) уменьшение концентрации ![]()
В) повышение температуры
1) влево
2) вправо
3) НЕ смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б3ВЗ. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 64,08 кДж теплоты. Полученный оксид кальция спекали с углем массой 18 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
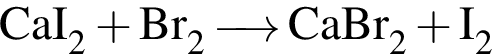
Определите сумму молярных масс (г/моль) кальцийсодержащих веществ Б и Г, полученных в результате превращений:
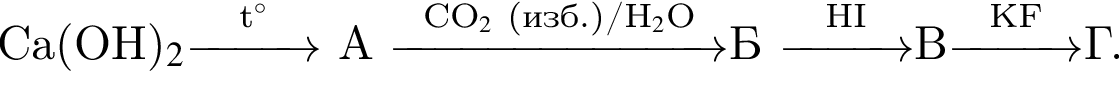
Получение синтез-газа 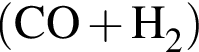 протекает по схеме:
протекает по схеме:
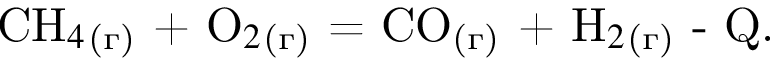
В результате реакции образовалась смесь ![]() и
и ![]() , содержащая водород объемом (н. у.) 235,2 дм3. При этом было израсходовано 721 кДж теплоты. Найдите количество теплоты (кДж), необходимой для получения 1 моль угарного газа в соответствии с уравнением реакции.
, содержащая водород объемом (н. у.) 235,2 дм3. При этом было израсходовано 721 кДж теплоты. Найдите количество теплоты (кДж), необходимой для получения 1 моль угарного газа в соответствии с уравнением реакции.
Взаимодействие хлорной кислоты с углеродом протекает по схеме
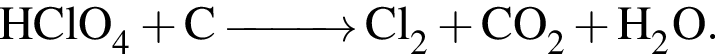
В результате реакции выделилось 32,48 дм3 оксида углерода(IV). Вычислите массу (г) вступившего в реакцию окислителя.
В результате полного восстановления водородом 40 г смеси меди и оксида меди(II) было получено 35,2 г твердого остатка. Определите массовую долю (%) металлической меди в исходной смеси.
Медную стружку массой 288 г при нагревании растворили в избытке концентрированной серной кислоты. Полученный газ полностью поглотили раствором гидроксида калия в мольном соотношении 1:2 соответственно. Рассчитайте, на сколько увеличилась масса (г) сосуда, содержавшего щелочь, в результате протекания реакции.
Смешали равные массы бромоводородной кислоты с массовой долей бромоводорода 24% и раствора нитрата серебра(I) с массовой долей соли 60%. Рассчитайте массовую долю (%) образовавшейся кислоты в растворе после полного завершения реакции.
Для производства чугуна был использован магнетит массой 224 кг с массовой долей ![]() 92,8% (других железосодержащих веществ в руде не содержалось). Определите массу (кг) полученного чугуна с массовой долей железа 96%, если выход продукта составляет 81%.
92,8% (других железосодержащих веществ в руде не содержалось). Определите массу (кг) полученного чугуна с массовой долей железа 96%, если выход продукта составляет 81%.
Для определения состава латуни (сплав меди с цинком) к ее образцу массой 22 г сначала добавили избыток азотной кислоты, затем — избыток цинкового порошка, затем — избыток соляной кислоты, причем каждый последующий реагент добавляли после завершения реакции с предыдущим. В результате всех превращений получили бесцветный раствор и осадок массой 15 г. Вычислите массовую долю (%) меди в латуни.

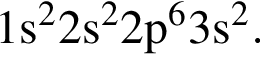 То есть все электроны спарены.
То есть все электроны спарены.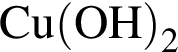 — нерастворимое в воде основание, которое будет взаимодействовать только с раствором кислоты, в данном случае с
— нерастворимое в воде основание, которое будет взаимодействовать только с раствором кислоты, в данном случае с 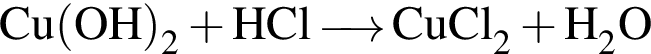
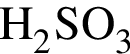 — сера находится в степени окисления +4.
— сера находится в степени окисления +4. — образуется одноосновная бескислородная кислота;
— образуется одноосновная бескислородная кислота; — образуется двухосновная кислородсодержащая кислота;
— образуется двухосновная кислородсодержащая кислота;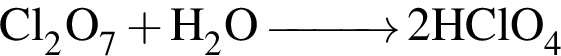 — образуется одноосновная кислородсодержащая кислота;
— образуется одноосновная кислородсодержащая кислота;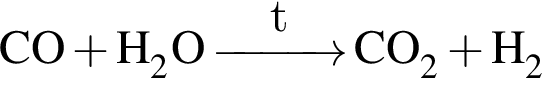 — кислота не образуется;
— кислота не образуется; — образуется бескислородная двухосновная кислота.
— образуется бескислородная двухосновная кислота.
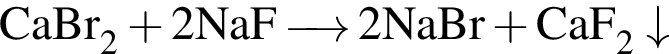
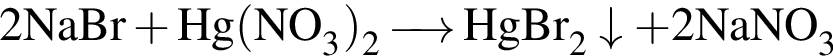 .
.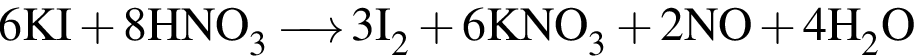
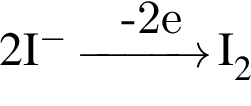
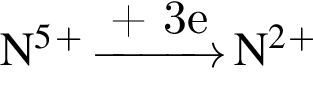
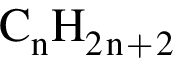 . Наличие двойной связи или цикла отнимают два атома водорода. Тройная связь отнимает 4 атома водорода.
. Наличие двойной связи или цикла отнимают два атома водорода. Тройная связь отнимает 4 атома водорода.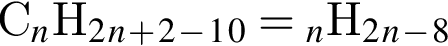 Ответ: 6).
Ответ: 6).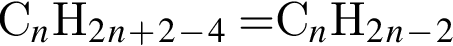 Ответ: 3).
Ответ: 3).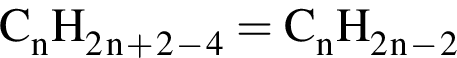 Ответ: 3)
Ответ: 3)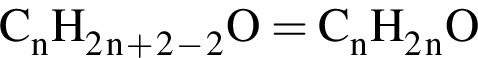 Ответ 8)
Ответ 8)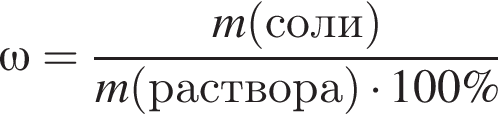
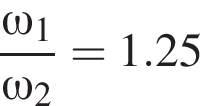
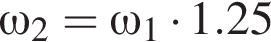
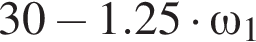 частей чистой соли и 70 частей раствора после упаривания, чтобы получился 30% раствор. Составив пропорцию получаем, что
частей чистой соли и 70 частей раствора после упаривания, чтобы получился 30% раствор. Составив пропорцию получаем, что 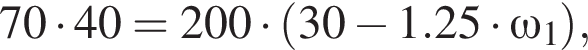 тогда
тогда 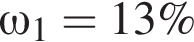
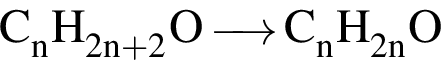
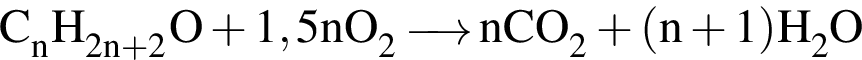
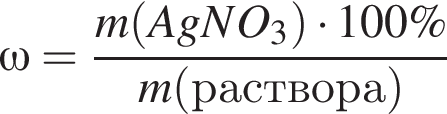
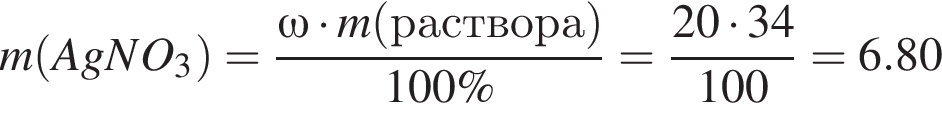
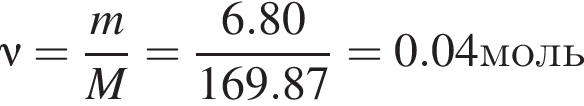
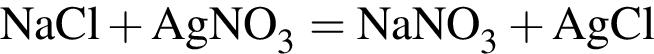 ↓
↓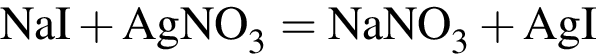 ↓
↓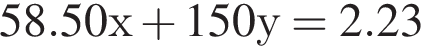
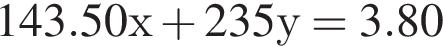
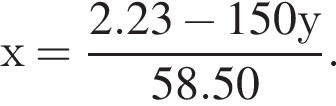 Подставим это выражение во второе уравнение системы.
Подставим это выражение во второе уравнение системы.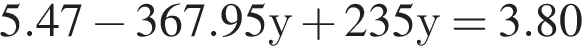 →
→ 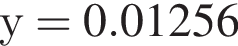 моль (
моль ( )
)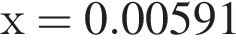 моль (
моль (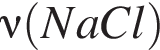 )
)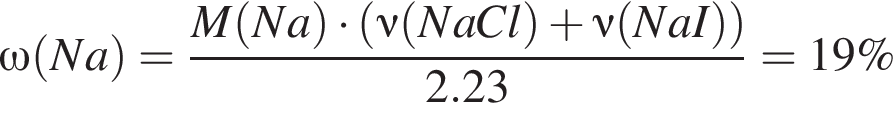
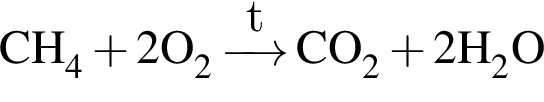
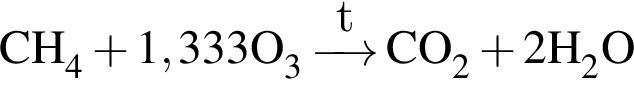
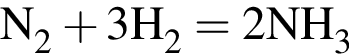 ;
; 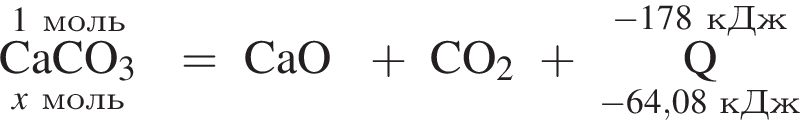
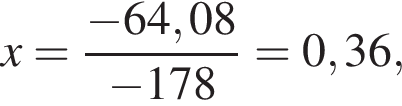

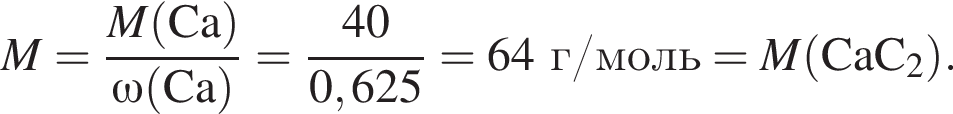
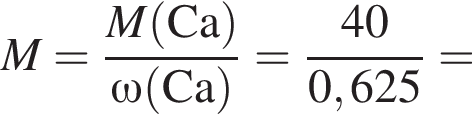
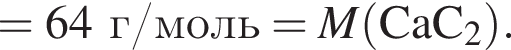
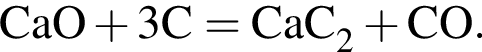
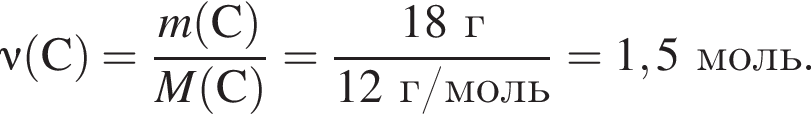
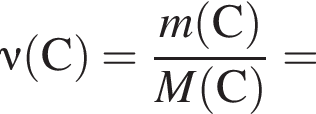
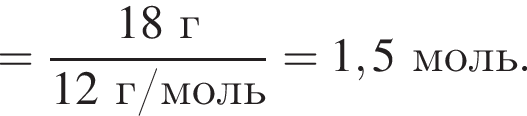

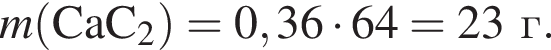

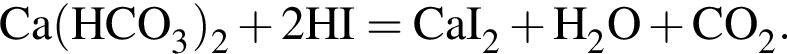
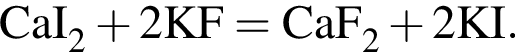

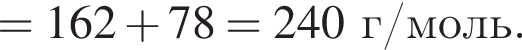

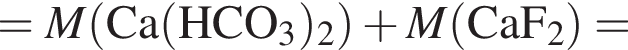
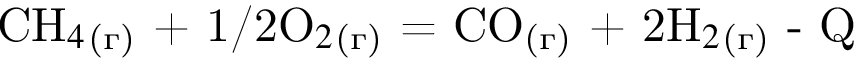
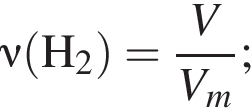
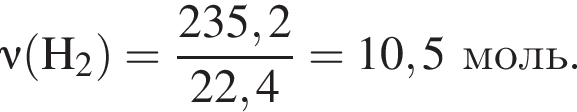
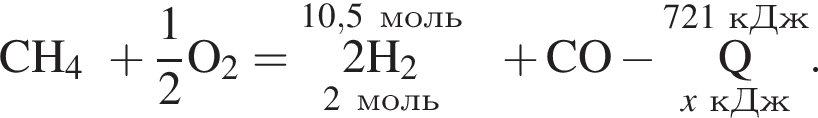
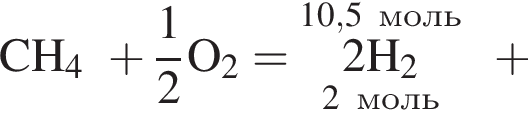
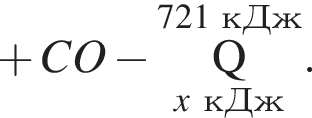
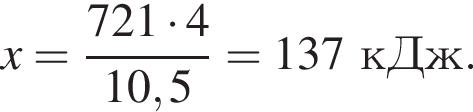
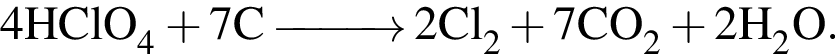
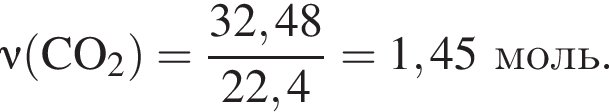
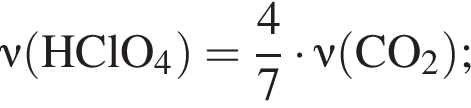
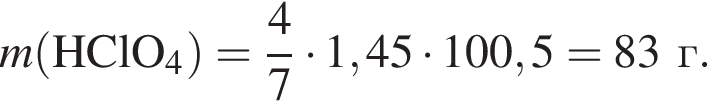
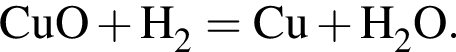
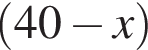 г меди. Тогда:
г меди. Тогда: